Nanogen bế tắc với câu hỏi “tại sao” của hội đồng đánh giá
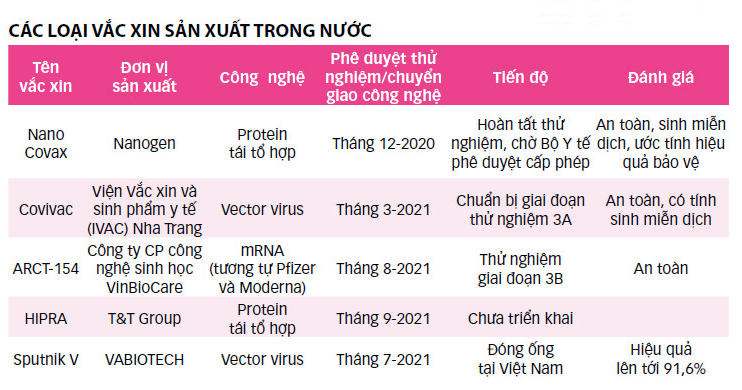
Kỳ vọng về một loại vắc xin phòng COVID-19 mang thương hiệu Việt Nam được khởi đầu từ thời điểm tháng 5-2020 khi Công ty cổ phần công nghệ sinh học dược Nanogen (gọi tắt Nanogen) bắt tay vào phát triển, thử nghiệm vắc xin Nano Covax trên động vật. Nano Covax là vắc xin đầu tiên đã hoàn thành thử nghiệm, được hội đồng y đức của Bộ Y tế thông qua.
Có ý kiến cho rằng vắc xin nội muốn tham gia “sân chơi” sắp tới thì phải chuyển hướng thử nghiệm hiệu quả mũi tiêm bổ sung (mũi booster) hoặc tiêm ngừa cho trẻ em ngay từ bây giờ.
Hiện chúng tôi đã cạn kiệt về tài chính và sự nhiệt tình, và đồng nghĩa với hiện tại nguồn vắc xin rất nhiều nhưng năm 2022 Việt Nam muốn tiêm bổ sung thì vẫn phải đi mua vắc xin.
Đại diện một nhà sản xuất trăn trở
Chờ mãi… vắc xin Việt
Kỳ vọng về một loại vắc xin phòng COVID-19 mang thương hiệu Việt Nam được khởi đầu từ thời điểm tháng 5-2020 khi Công ty cổ phần công nghệ sinh học dược Nanogen (gọi tắt Nanogen) bắt tay vào phát triển, thử nghiệm vắc xin Nano Covax trên động vật. Nano Covax là vắc xin đầu tiên đã hoàn thành thử nghiệm, được hội đồng y đức của Bộ Y tế thông qua.
Trong suốt hơn một năm rưỡi, có lúc tưởng chừng loại vắc xin này được cấp phép lưu hành, tuy nhiên đến nay sau nhiều cuộc họp của hội đồng đạo đức trong nghiên cứu y sinh quốc gia, vắc xin này vẫn trong trạng thái “chờ được phê duyệt”.

Theo một chuyên gia theo sát quá trình nghiên cứu của vắc xin Nano Covax, việc chậm được cấp phép một phần xuất phát từ năng lực sản xuất, tổ chức nghiên cứu, tiếp thị và năng lực tài chính của Nanogen. Và dù không thể phủ nhận loại vắc xin này có hiệu quả, tuy nhiên công nghệ có một số điểm vẫn thua kém các loại vắc xin nước ngoài. Do đó, kết quả cuối cùng chưa thực sự thuyết phục hội đồng chuyên môn.
“Chưa kể khi đơn vị nộp hồ sơ nhiều xét nghiệm vẫn còn thiếu, bổ sung chậm chứ chưa phải hoàn thiện hoàn toàn, cho nên việc phê duyệt chậm cũng là điều dễ hiểu” – vị này nói.
Trong khi đó, trao đổi với PV, một đại diện của Nanogen cho biết đơn vị khá bế tắc với các câu hỏi “tại sao” từ thành viên của hội đồng đánh giá. Vị này cho rằng Nano Covax là loại vắc xin đầu tiên phòng COVID-19 nghiên cứu tại Việt Nam. Khi đơn vị bắt tay vào nghiên cứu năm 2020, không có nhiều loại vắc xin trên thế giới có đầy đủ dữ liệu như vắc xin Nano Covax.
“2 – 3 tháng nay có rất nhiều cuộc họp, chúng tôi được yêu cầu bổ sung hoài nên cũng khá mệt mỏi” – vị này chia sẻ. Vậy nếu được phê duyệt cấp phép, liệu cơ hội của Nano Covax còn nhiều không?
Ngoài Nano Covax, một vắc xin Việt được kỳ vọng khác là Covivac của Viện Vắc xin và sinh phẩm y tế (IVAC) Nha Trang phát triển, với sự hỗ trợ tích cực từ Tổ chức PATH. Sau thử nghiệm giai đoạn 1, 2 “có triển vọng”, kế hoạch giữa tháng
12-2021 đơn vị sẽ tiêm thử nghiệm giai đoạn 3 với 4.000 người tham gia. Nhưng trớ trêu ngay tháng 11, Việt Nam dự kiến phủ xong mũi 1 cho người từ 18 tuổi trong toàn quốc, lấy đâu ra 4.000 tình nguyện viên chưa tiêm ngừa? Vì vậy, kế hoạch tiêm thử nghiệm giai đoạn 3 của vắc xin này cũng đã chuyển sang tháng 11, nhưng nếu không kịp đề cương, thủ tục để bắt đầu tiêm từ 20-11 thì việc tiêm thử nghiệm cũng sẽ đổ bể.
Không thể thử nghiệm do… không có người
Đại diện nhóm nghiên cứu thử nghiệm lâm sàng Hippra (vắc xin do Tây Ban Nha phát triển và Việt Nam đã ký hợp đồng nhận chuyển giao công nghệ) cho biết theo hợp đồng, Việt Nam sẽ thử nghiệm lâm sàng giai đoạn 2b và giai đoạn 3 vắc xin này.
“Khâu tìm địa điểm thử nghiệm hiện rất khó khăn do đã có trên 82% người từ 18 tuổi ở Việt Nam sẽ được tiêm mũi 1 trong tháng 11, nên chúng tôi chỉ có thể triển khai tiêm thử nghiệm giai đoạn 2b với vắc xin Hippra, còn giai đoạn 3 là không thể do không còn người chưa tiêm” – vị đại diện này chia sẻ.
Ngay thử nghiệm giai đoạn 2b, với số lượng người tham gia ít ỏi – chỉ 256 người cũng rất khó khăn. Nhóm nghiên cứu đã có văn bản đề nghị được tiêm thử nghiệm ở Nam Định nhưng Nam Định đã từ chối, đến 5-11 có Sơn La và Thanh Hóa chấp thuận cho phép tiêm thử nghiệm Hippra, nhưng cái khó là đường đi từ Sơn La về Hà Nội kéo dài 6-7 giờ, sẽ ảnh hưởng đến chất lượng mẫu đánh giá sau tiêm.

Vì vậy nhóm nghiên cứu đã có kế hoạch triển khai tại Thanh Hóa, nhưng đang “vắt chân lên cổ” để làm sao tiêm vào thứ bảy, chủ nhật tuần sau, nếu không cũng sẽ không kịp.
Trong các loại vắc xin sản xuất trong nước đến thời điểm này thì Vabiotech, đơn vị nhận gia công, đóng ống vắc xin Sputnik V tại Việt Nam, đã sản xuất lô vắc xin thương mại với số lượng 1 triệu liều để sẵn trong kho.
Ông Đỗ Tuấn Đạt – chủ tịch Vabiotech – cho biết hy vọng của Vabiotech là Sputnik V đóng ống tại Việt Nam kịp được Bộ Y tế cấp phép vào tháng 11 này, và như vậy vẫn còn “dư địa” 500.000 người chưa được tiêm mũi 1 để sử dụng 1 triệu liều Sputnik V đã sản xuất.
Chờ “đá hiệp phụ”?
Vậy cơ hội cho từng loại vắc xin như thế nào? PGS.TS Đỗ Văn Dũng – trưởng khoa y tế công cộng Trường ĐH Y dược TP.HCM – cho rằng với loại vắc xin đã thử nghiệm chờ phê duyệt (như Nano Covax) có thể sử dụng hướng đến tiêm mũi tăng cường nếu khi tỉ lệ tiêm chủng đã bao phủ cộng đồng.
Theo ông Dũng, độ tương thích giữa các loại vắc xin hiện được đánh giá rất nhanh, chỉ cần nghiên cứu trên vài trăm người để xác định lượng kháng thể đáp ứng sau mũi tăng cường.
“Với nhiều loại vắc xin khác nhau, nhiều người đã từng lo ngại việc không tương thích khi tiêm mũi tăng cường nhưng các nghiên cứu gần đây lại cho thấy hầu như các loại vắc xin đều dùng một loại kháng nguyên giống nhau, do đó cơ bản đảm bảo độ tương thích tối thiểu. Các loại vắc xin này khi phối hợp với nhau đều cho kết quả bằng hoặc tốt hơn vắc xin gốc” – ông Dũng phân tích thêm và cho rằng nếu thuận lợi, vắc xin Nano Covax có thể đã được cấp phép từ hồi tháng 8-2021 để tiêm cho người dân, thay vì chờ “đá hiệp phụ” (mũi tăng cường) như bây giờ.
Ông Dũng cũng cho rằng hiện thử nghiệm theo phương pháp cũ (chọn người chưa tiêm vắc xin) gần như không thể khi đa phần đều được khuyến cáo tiêm ngừa càng sớm càng tốt, trừ một số trường hợp trì hoãn do bệnh lý. Tuy vậy không hẳn “hết đường” vì ngoài phương pháp này, hiện khoa học cho phép đánh giá tính sinh miễn dịch nhằm suy ra hiệu lực vắc xin.
Còn ông Vũ Đình Thiểm – chuyên gia lâu năm trong thử nghiệm lâm sàng thuốc và vắc xin, phụ trách Trung tâm thử nghiệm lâm sàng của Viện Vệ sinh dịch tễ trung ương – cho biết ở châu Âu, vắc xin COVID-19 thử nghiệm lâm sàng xong giai đoạn 1 có thể chuyển sang thử nghiệm mũi tiêm bổ sung.
Nhưng một chuyên gia khác cho rằng cái khó hiện nay là quy định của Việt Nam vẫn yêu cầu các nhà sản xuất vắc xin phải có đủ dữ liệu lâm sàng mũi tiêm cơ bản mới được chuyển sang thử nghiệm liều bổ sung.
Trong khi hiện nay ngoài Nano Covax và Sputnik V, 3 vắc xin sản xuất trong nước/nhận chuyển giao công nghệ còn lại đều đang ở giai đoạn 2 – 3 thử nghiệm lâm sàng, chưa đủ dữ liệu hiệu quả 2 mũi tiêm cơ bản theo yêu cầu hiện hành. Muốn gỡ khó cho các nhà sản xuất để họ có cơ hội đưa vắc xin nội tham gia thị trường vắc xin, cần thay đổi sớm về chính sách để vắc xin nội thử nghiệm liều tiêm bổ sung.
Cơ hội cho mũi tăng cường hoặc tiêm trẻ em
Đến 6-11 đã có trên 89 triệu mũi vắc xin đã được tiêm, tương đương khoảng 83% người từ 18 tuổi đã tiêm ít nhất 1 mũi, tỉ lệ tiêm đủ 2 mũi đang tiến đến mốc 40%. Theo thông tin từ Chương trình Tiêm chủng mở rộng quốc gia, trong tháng 11 này sẽ có thêm 34 triệu liều vắc xin về Việt Nam và mục tiêu trong tháng 11 sẽ phủ mũi 1 cho người từ 18 tuổi toàn quốc.
Trong tình huống như vậy, 5 loại vắc xin sản xuất/nhận chuyển giao công nghệ tại Việt Nam gần như đã “hết cửa” với liều tiêm cơ bản. Cơ hội với họ, hiện là liều tiêm bổ sung hoặc chuyển sang nghiên cứu hiệu quả tiêm ngừa cho trẻ em.
Tự chủ vắc xin vẫn rất quan trọng
Tuy vắc xin Việt đang gặp khó khăn nhưng theo các chuyên gia, dịch COVID-19 chưa thể chấm dứt, do đó việc tiêm cho dân số mới, người bị bệnh nền, lớn tuổi hoặc tiêm nhắc lại là điều tất yếu; nhu cầu về vắc xin sẽ có lâu dài trong tương lai chứ không phải ngày một ngày hai.
Chính trong lúc phải đẩy nhanh việc tìm kiếm vắc xin từ nhiều nguồn với phương châm “vắc xin tốt nhất là vắc xin tiêm sớm nhất”, Bộ trưởng Bộ Y tế Nguyễn Thanh Long cho biết việc chưa thể tự sản xuất được vắc xin trong nước khiến tình hình tiếp cận vắc xin của Việt Nam và nhiều nước trên thế giới gặp không ít khó khăn.
Chấp nhận rủi ro nếu cứ “đeo” theo vắc xin ngoại
Có 3 khó khăn được người đứng đầu ngành y tế đúc kết, bao gồm phải chấp nhận hầu hết các điều kiện mà các nhà cung ứng vắc xin đưa ra như vấn đề thỏa thuận bồi hoàn, miễn trừ về trách nhiệm, bảo mật thông tin và cả rủi ro liên quan đến giao hàng không đúng thời hạn; khan hiếm nguồn cung ứng vắc xin trên toàn cầu.
Ngay cả với cơ chế COVAX, cơ chế được kỳ vọng đảm bảo quyền tiếp cận công bằng trên toàn cầu đối với vắc xin, cũng chưa đạt được kế hoạch cung ứng cho các nước, trong đó có Việt Nam. Khi các nước thay đổi chính sách mở rộng đối tượng tiêm, tiêm tăng cường mũi 3 thì việc tiếp cận càng khó khăn hơn.
Chia sẻ với ý kiến của bộ trưởng Bộ Y tế, một chuyên gia về vắc xin nói với chúng tôi rằng cần phải làm cách nào đó để đẩy nhanh được các điều kiện để có thể sớm đưa vắc xin Việt vào sử dụng càng sớm càng tốt. Nếu tiếp tục chần chừ, chậm trễ, Việt Nam sẽ tiếp tục tốn hàng ngàn tỉ đồng để mua vắc xin cho năm 2022, trong lúc vắc xin trong nước lại giậm chân tại chỗ.
Khó khăn nhưng không nên dừng lại
Phân tích về tình hình các nhà sản xuất vắc xin nội, PGS.TS Đỗ Văn Dũng cho rằng khi bắt tay vào nghiên cứu, các đơn vị có tham vọng không chỉ cung ứng trong nước mà còn xuất khẩu nhưng hiện nay các loại vắc xin, đặc biệt theo công nghệ mRNA sản xuất rất nhanh và chi phí đầu vào rất thấp, do đó thị trường vắc xin sẽ cạnh tranh nhau rất dữ dội.
Các nhà sản xuất trong nước cũng phải chấp nhận thực tế thị trường sẽ nhỏ đi rất nhiều, lợi nhuận cũng sẽ ít đi và tất nhiên sự hào hứng của các nhà sản xuất sẽ phần nào suy giảm, thậm chí rút lui để bảo toàn nguồn vốn.
Một chuyên gia trong lĩnh vực thử nghiệm lâm sàng thì chia sẻ các đơn vị sản xuất vắc xin COVID-19 Việt giờ đều bạc tóc hết rồi. “Chúng tôi cũng rất chia sẻ với họ vì đâm lao phải theo lao, đầu tư nghiên cứu vắc xin chi phí cả ngàn tỉ đồng, kết quả tưởng trước mắt nhưng đến nay thực tế tương lai bất định nếu không sớm có phương án gỡ khó. Trong nghiên cứu khoa học, cụ thể là phát triển vắc xin, nếu không có con đường riêng thì Việt Nam sẽ luôn luôn đi sau” – vị này nói.
Cần khơi thông cơ chế hơn
Ông Đỗ Văn Dũng cũng cho rằng Nhà nước và đặc biệt là Bộ Y tế cần phải có cơ chế ủng hộ, tạo niềm tin cho các đơn vị sản xuất vắc xin trong nước, bởi nếu không có họ việc chống dịch về lâu dài sẽ vô cùng khó khăn. Việc chủ động, tự lực về vắc xin là vấn đề quan trọng.
“Việc thúc đẩy có vắc xin trong nước là trách nhiệm của Nhà nước trong việc đảm bảo an ninh y tế lâu dài. Muốn vậy phải đưa ra các quy định rõ ràng, minh bạch để cho các loại vắc xin đáp ứng đủ điều kiện được phê duyệt sản xuất, cung ứng tiêm chủng cho người dân sớm nhất” – ông Dũng nói.
Bên cạnh đó, ông cho rằng các công ty cũng phải tích cực thực hiện các nghiên cứu thử nghiệm đáp ứng yêu cầu của hội đồng quốc gia về vắc xin đặt ra.
Lan Anh



